Afinidad Electronica De Los Elementos
A Toma valores nulos para un gas noble b Alcanza valores máximos para los gases nobles c Toma valores negativos en los periodos de izquierda a derecha. Gaseoso en su estado fundamental capta un electrón libre y se convierte en un ión mononegativo.
Que Poca Afinidad Tienen Algunos
La AE es una propiedad periódica por lo que vamos a ver también como v.
Afinidad electronica de los elementos. Este proceso es exotérmico por lo tanto es una magnitud negativa ΔH 0Difícilmente puede establecerse generalidades en un grupo o periodo de la tabla acerca de la Afinidad electrónica pero podría. Te cuesta entender la afinidad electrónica. C O Si P Ca Ba.
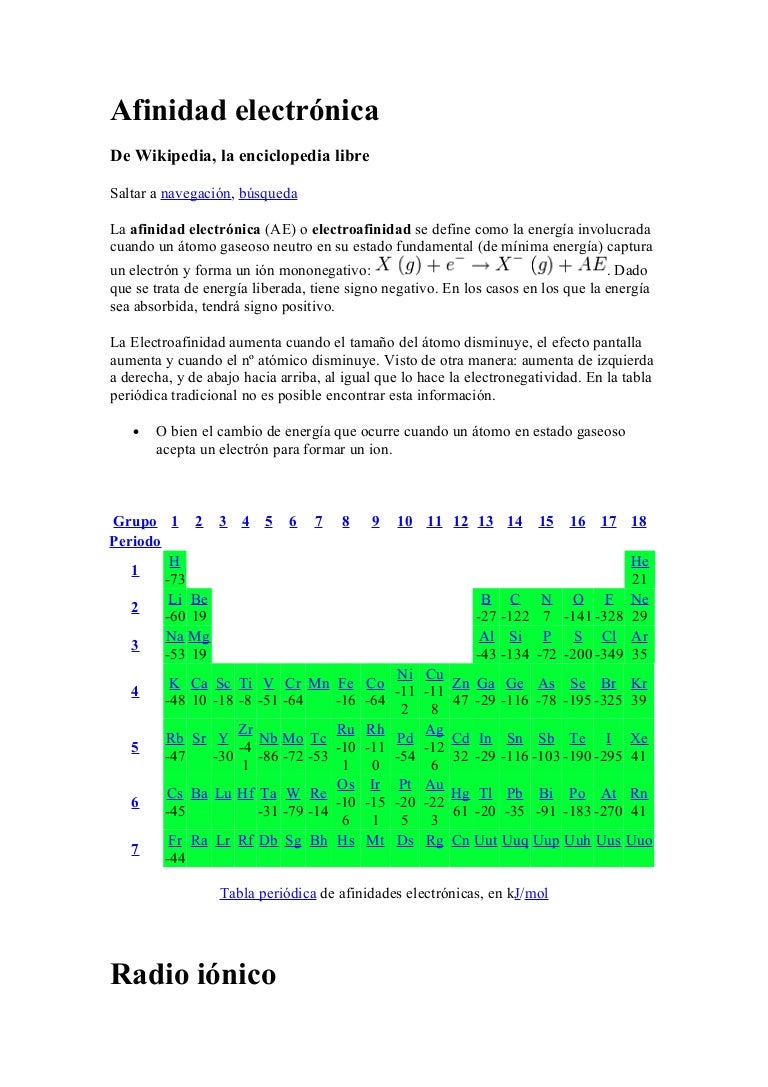
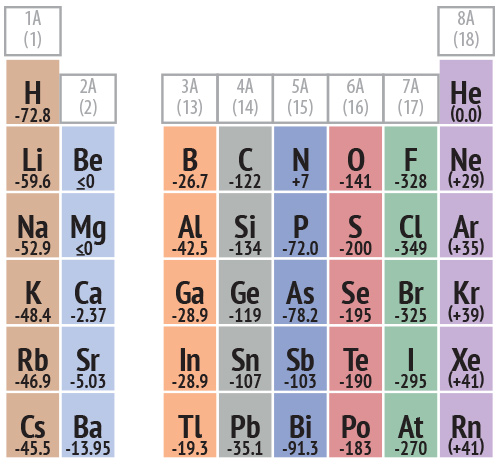
Estos elementos próximos al flúor específicamente el nitrógeno el oxígeno y el cloro son los que poseen los mayores valores de A e. La afinidad electrónica de los elementos aumenta dentro de un mismo periodo del sistema periódicode izquierda a derecha. B F Cl Br I.
Organice en orden descendente los siguientes elementos de acuerdo a su afinidad electrónica. Afinidad electrónica de los elementos de la tabla periódica Los átomos no solo pierden electrones para formar iones positivos sino que también los ganan para formar iones negativos. A partir del cloro la tendencia es la esperada en función de la mayor distancia de los electrones exteriores al núcleo.
La segunda afinidad electrónica o energía de adición de un segundo electrón para un elemento es siempre positiva porque las repulsiones interelectrónicas son mayores que las fue rzas de atracción. De manera semejante ocurre en el bloque p donde se puede observar que las afinidades electrónicas se hacen cada vez más negativas de izquierda a derecha. Por ejemplo cuando un átomo de cloro neutro en forma gaseosa recoge un electrón para formar un ion Cl- libera una energía de 349 kJmol o 36 eVátomo.
Recibe ahora mismo las respuestas que necesitas. Más de 12000 datos sobre los elementos organizados en tablas y gráficas. Hola Amigos de la QuímicaEn el vídeo de hoy explicamos la afinidad electrónica AE.
La Afinidad Electrónica o la Electroafinidad A La afinidad electrónica es la energía absorbida cuando un átomo en estado gaseoso acepta un electrón. Objeto de aprendizaje con el cual el usuario aprenderá el concepto de afinidad eléctrica y su comportamiento a través de la tabla periódica además de la relación que existe entre la afinidad electrónica y el comportamiento químico de los elementos. Sin embargo a diferencia del radio atómico y la energía de ionización esta propiedad de los elementos químicos no tiene un comportamiento regular a lo largo de la tabla periódica ya que depende de muchos factores.
Afinidad electrónica aumenta generalmente mueve de izquierda a derecha a través de un período elemento fila de la tabla periódica. A P As y Sb b. Ejercicios 860 Explique las tendencias en la afinidad electrónica desde el aluminio hasta el cloro 8861 Acomode los elementos de cada uno de los siguientes grupos en orden creciente de la afinidad electrónica más positiva.
El nitrógeno tiene una afinidad electrónica muy por debajo de sus elementos vecinos tanto del periodo como de su grupo lo que es debido a su capa de. Los elementos químicos presentan mayor afinidad electrónica cuanto más arriba y a la derecha de la tabla periódica se encuentren Al igual que la energía de ionización y el poder oxidanteEs decir el elemento con mayor afinidad electrónica es el Flúor Fes el elemento que se encuentra más arriba y a la derecha de la tabla periódica Sin tener en cuenta. 13 rows Afinidades Electrónicas de los Elementos del Grupo Principal La afinidad electrónica es una medida de la variación de energía cuando se añade un electrón a un átomo neutro para formar un ion negativo.
No te preocupes en este vídeo entenderás a la perfección todo sobre la afinidad electrónica con explicación. De esa magnitud se podría decir que. 50000 5 3 0.
Electron aumentos de afinidad mover hacia abajo un grupo de elementos columna de la tabla periódica. La afinidad electrónica es otra propiedad periódica que nos da información sobre el comportamiento químico de los elementos. A Li Na K.
Como su nombre lo indica afinidad electrónica AE es una medida de tendencia de un átomo a ganar un electrón Cuanto mayor es la afinidad electrónica de un átomo es más probable que gane un electrón. X g e X g. La excepción es los gases nobles que están en la última columna de la tabla.
Afinidad electrónica en los grupos de la tabla periódica La afinidad electrónica disminuye en la medida que se baja en tabla periódica considerando los elementos del mismo grupo. Las mayores Afinidades Electrónicas las presentan los Halógenos Flúor Cloro Bromo Iodo El Nitrógeno presenta una anomalía ya que su afinidad electrónica es mucho menor que los elementos vecinos de la Tabla Periódica debido a que por su configuración electrónica es muy estable. Elementos químicos y periodicidad.
De acuerdo con las convenciones el signo de esta energía.

Afinidad Electronica Propiedades Periodicas De Los Elementos Quimica
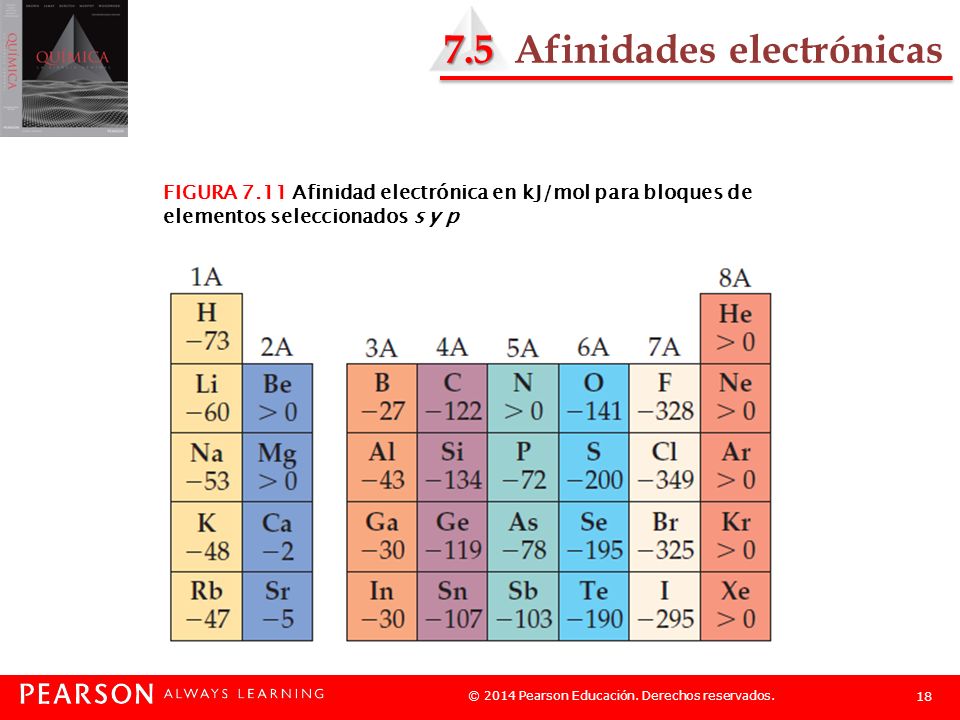
7 5 Afinidades Electronicas La Fisica Y Quimica
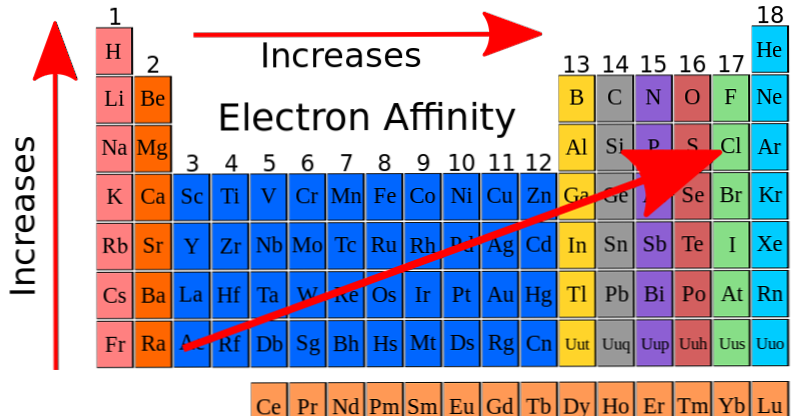
Diferencia Entre Electronegatividad Y Afinidad Electronica Ciencia La Diferencia Entre Objetos Y Terminos Similares
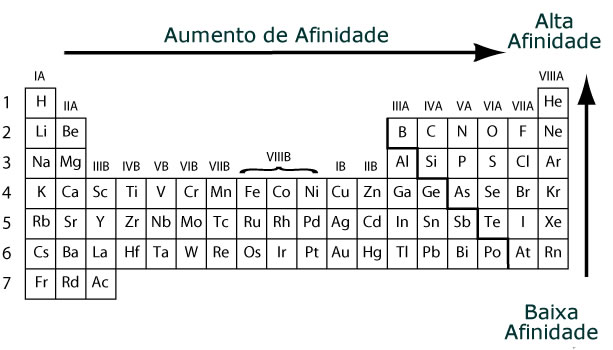
Afinidad Electronica Electroafinidad Quimica Definiciones Y Conceptos

Que Es La Afinilidad Electronica Definicion Usos Y Ejemplos Yubrain
Afinidad Electronica Fisicoquimica
Como Se Explica La Electronegatividad Quora
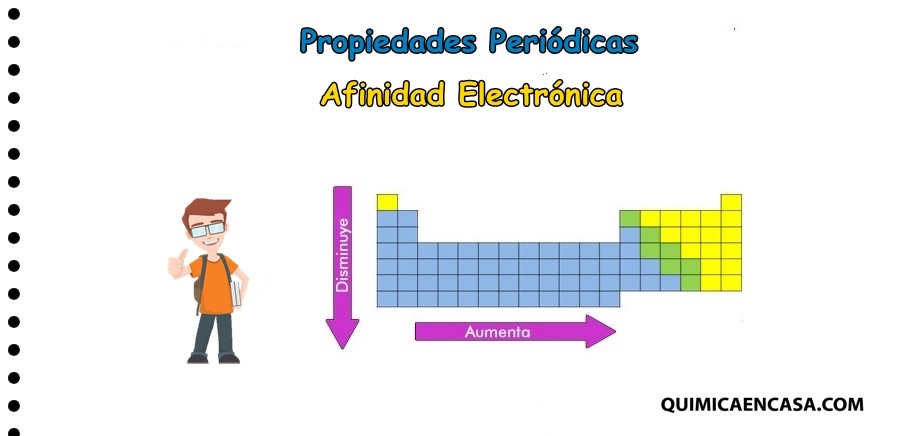
Propiedades Periodicas Afinidad Electronica Quimica En Casa Com

Ordena Segun Su Afinidad Electronica De Menor A Mayor Los Siguientes Elementos As Se K Br Brainly Lat
Como Varia La Electronegatividad En La Tabla Periodica

Afinidad Electronica Quimicaycreatividad
2 2 4 Afinidad Electronica Angeles Pava Quimica
Https Fyq2016 Weebly Com Uploads 6 0 0 9 60092831 Afinidad Electr C3 B3nica Pdf

Quimica 1 4 3 Afinidad Electronica






Posting Komentar untuk "Afinidad Electronica De Los Elementos"