Como Se Forma Un Enlace Pi
Los enlaces pi son más difusos que los enlaces sigma. Molécula de cloro Cl2 La molécula de Cl 2 se explica como la de H 2.
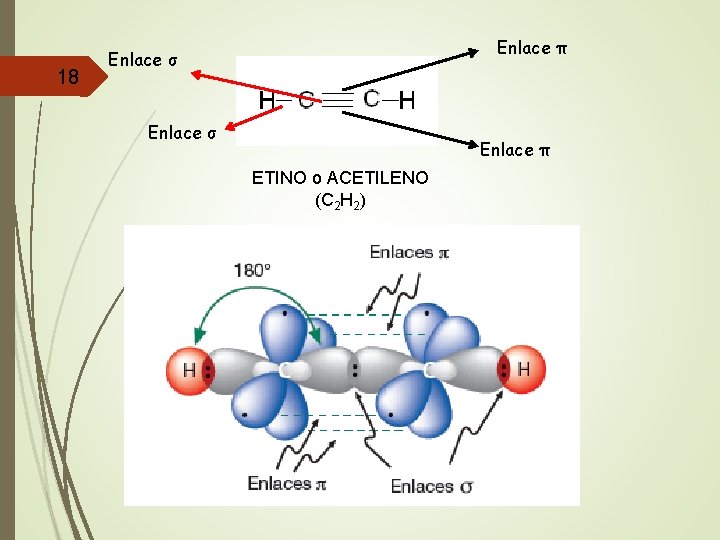
Unidad De Enlace 0 Qumica Orgnica Tema 1
Un enlace covalente triple se forma por tres pares electrónicos compartidos es decir por tres electrones pertenecientes al último nivel de energía de cada átomo.

Como se forma un enlace pi. Un enlace pi enlace π es un enlace covalente formado entre dos vecinos del átomo no unidas orbitales p. Es la unión de un enlace simple es decir un orbital sp3 con el orbital sp3 de otro carbono. En el caso de los pi estos se forman por combinación de dos orbitales p como estos tienen forma de cacahuete la combinación de ambos da un orbital pi que tiene dos zonas una por encima del enlace y.
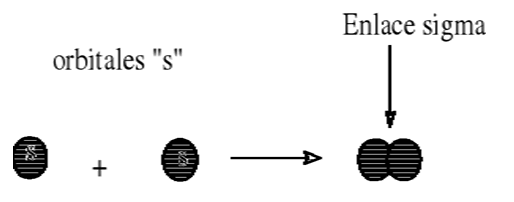
Enlace Covalente Polar Se denomina de esta manera a un enlace que no comparte de igual manera su par de electrones debido a la diferencia en la electronegatividad que tienen los átomos que forman la molécula. Este par de electrones forma el enlace pi. Los enlaces sigma σ forman un solapamiento frontal de dos orbitales atómicos que suelen ser diferentes o iguales.
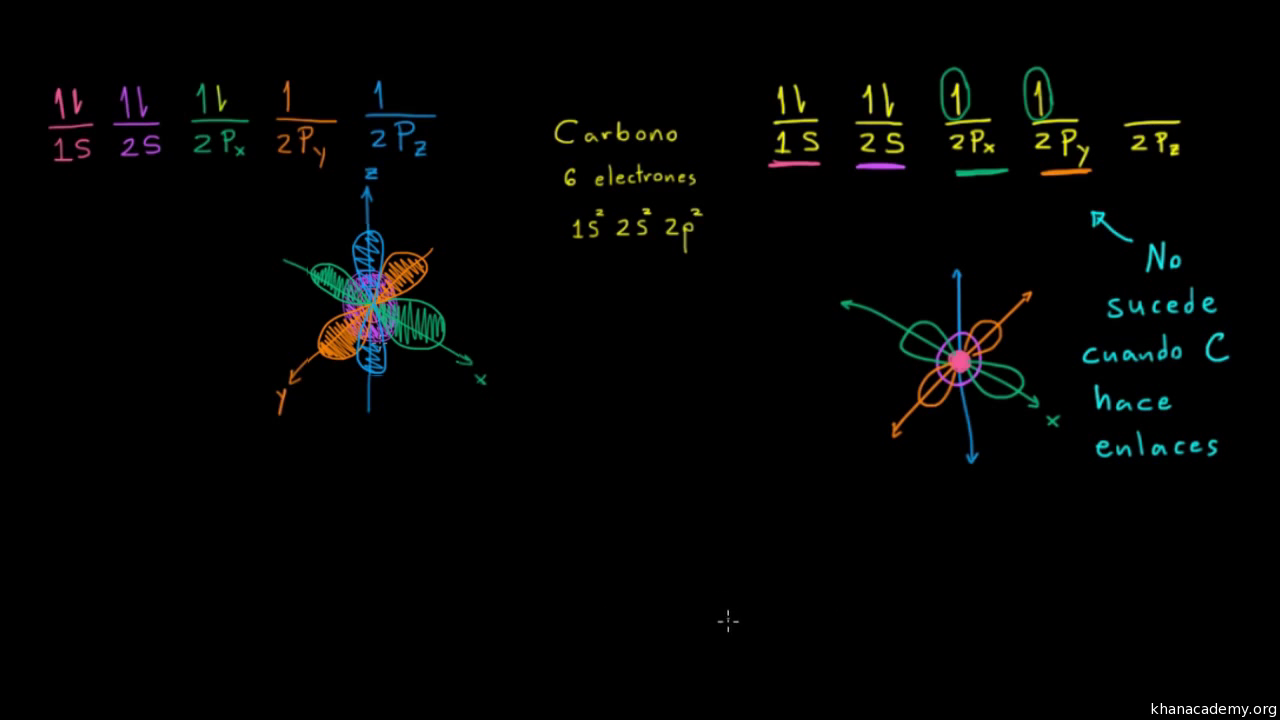
El enlace sigma puede formarse como producto de la hibridación de dos orbitales s un orbital s y uno p o dos orbitales p que se hibridan lateralmente. Los enlaces pi no participan en la hibridación lo que se ve reflejado en que dos orbitales p no interviene en la misma por eso se coloca el spin flecha en forma de puntitos. Es la unión de un doble en este caso la unión sería con orbitales sp2 o triple enlace en este otro caso sería lo mismo pero con orbitales sp1sp Así que.
Propanonitrilo CH 3 CH 2 CN. Los electrones en los enlaces pi son referidos algunas veces como electrones pi. En la figura de arriba observamos dos orbitales p formando un enlace π.
El enlace pi comparte 1 electron solo que las zonas pintadas azules es donde se puede encontrar el elctron compartido recordemos que los orbitales son probabilidades de encontrar un electron. El enlace pi π es un enlace covalente formado por la hibridación de dos orbitales atómicos pLos orbitales d también pueden participar en este tipo de enlace. En este caso los electrones del enlace se encuentran en una nube entre los dos átomos del enlace.
Este compuesto posee un enlace triple C-N. Ne 3s 2 3p x2 3p y1 3p z2. Qué es más fácil de romper un enlace simple o doble.
El botón abre una ventana para registro. Un p-orbital no unido de electrones en un átomo forma un par de electrones con electrones no unido paralelo p-orbital de un átomo vecino. 21 Enlaces sigma y pi.
El primero sería un enlace π pz-pz y el otro sería π py-pzAmbos enlaces pi se encuentran en planos perpendiculares uno con el otro ya que los orbitales p y y p z son perpendiculares entre sí. Los enlaces pi resultan del traslape de orbitales atómicos que tienen dos áres de traslape. El orbital sigma se define de forma más clara para moléculas diatómicas usando el lenguaje y las herramientas de la simetría de grupos.
Los fragmentos moleculares unidos por un enlace pi no pueden rotar libremente alrededor del enlace sin la ruptura. El enlace sigma se forma por hibridación de orbitales. Dobles enlaces y triples entre átomos se componen.
Este tipo de enlace no posee tanta energía como el enlace sigma dado que los electrones que los forman se encuentran más alejados del núcleo y por. Así que el carbono forma dos enlaces pi uno con un oxígeno y otro con el otro. Como cada uno de los dos átomos de cloro tiene un orbital con un electrón se superponen frontalmente los.
En este caso el enlace. Comentar en la publicación El enlace pi comparte 1 e de oscarcastillom. En esta aproximación formal un enlace σ es simétrico.
El enlace sigma enlace σ es el tipo más fuerte de enlace químico covalente incluso más fuerte que el enlace pi el cual forma el doble enlace. La teoría MO da cuenta de estas observaciones con el concepto de enlace pi deslocalizado. Si bien el enlace pi no es tan fuerte como el sigma la suma del sigma más el pi uniendo un par de átomos va a ser más.
Energía de Enlace Es la energía que se libera cuando dos átomos se unen dando origen a un enlace covalente. Se observa también que el enlace C 2-C 3 si bien es más largo que los dobles enlaces C 1-C 2 and C 3-C 4 es significativamente más corto que un enlace típico C-C simple. El enlace sigma es un tipo de enlace covalente que se forma por hibridación de orbitales atómicos.
El enlace sigma es uno de los enlaces más fuertes con mayor estabilidad. Ahora vas a ver cómo se forman algunas moléculas sencillas según la teoría de enlace de valencia.

Tomi Digital Enlace Covalente Sigma Y Pi

Enlace Sigma Que Es Como Se Forma Caracteristicas Ejemplos
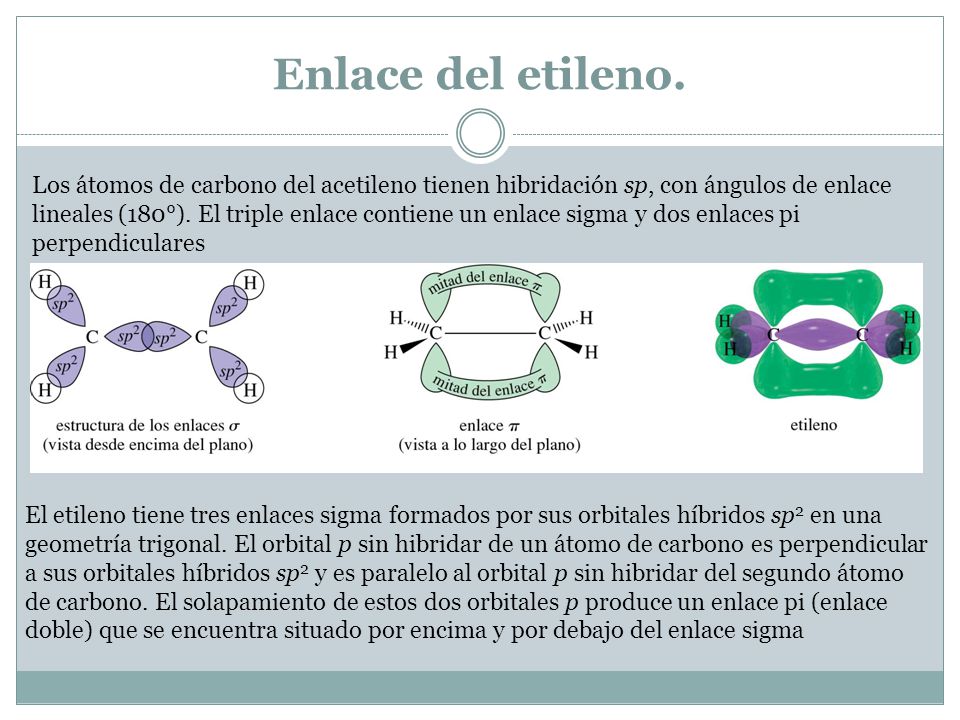
Estructura Y Propiedades De Las Moleculas Organicas Ppt Video Online Descargar

Quimica 2 El Carbono Y Sus Compuestos Enlaces Sigma S Y Pi P

Quimica Organica Rama De La Quimica Que Estudia Los Compuestos Organicos Es Decir Tienen En Su Estructura El C Se Penso Que Los Compuestos Organicos Ppt Descargar

1 1 4 Tipos De Orbitales Que Forman Enlaces Sigma Y Pi Enlaces S Y Enlaces P A La Vista De La Forma En La Que Los Enlaces Se Representan En Las Formulas Quimicas Puede Pensarse Que Los Diferentes Enlaces De Una Union Multiple Entre Dos Atomos De
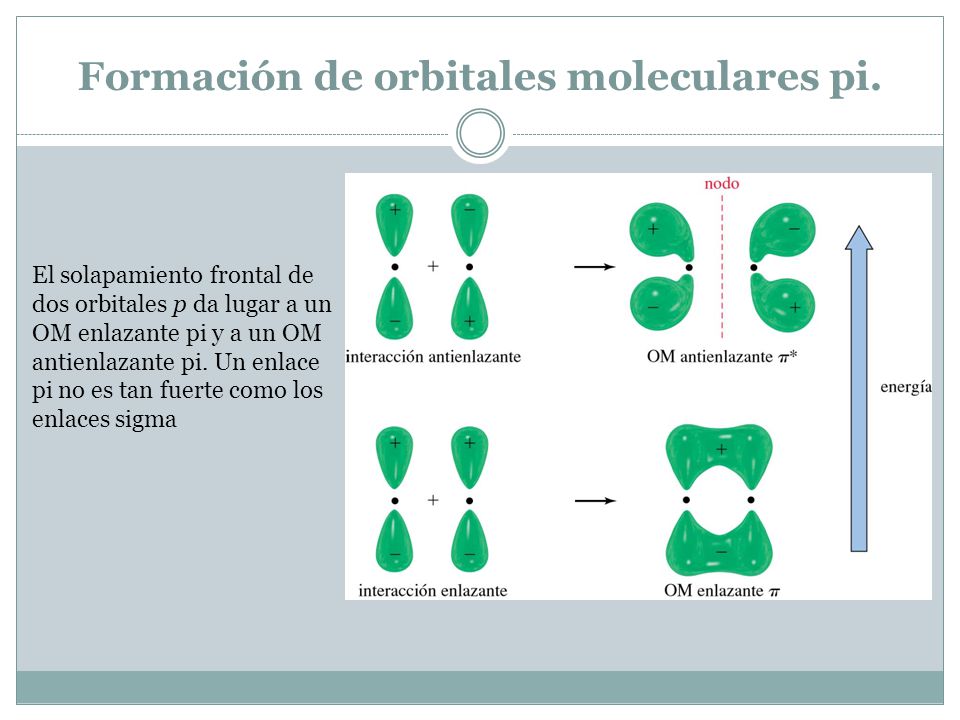
Estructura Y Propiedades De Las Moleculas Organicas Ppt Video Online Descargar

Que Es El Enlace Pi Y Sigma By Valeria Mustafa
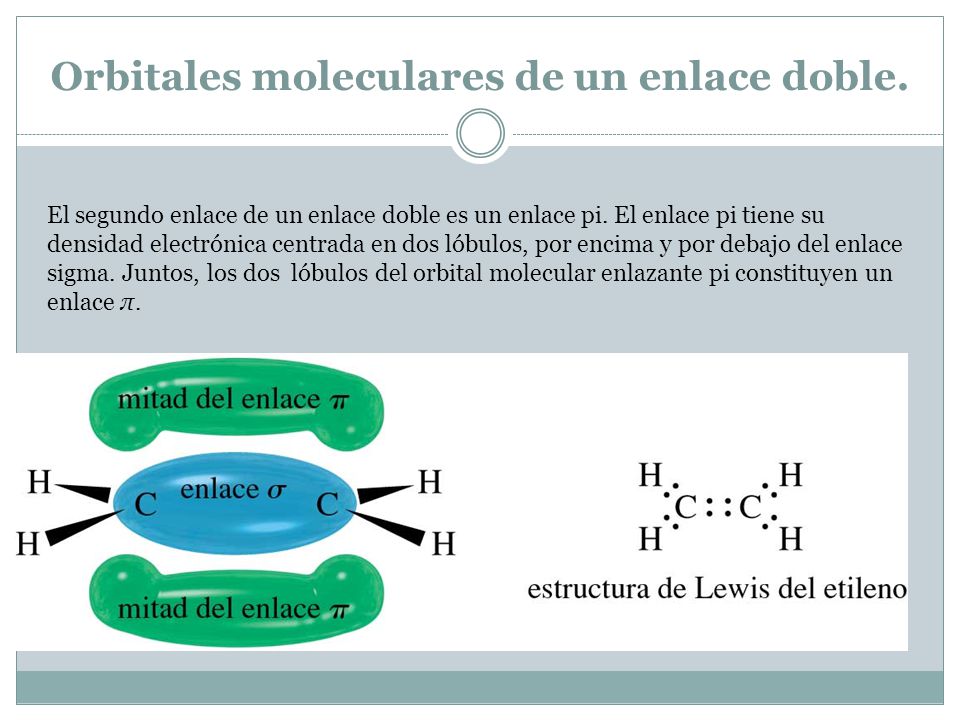
Estructura Y Propiedades De Las Moleculas Organicas Ppt Video Online Descargar

1 1 4 Tipos De Orbitales Que Forman Enlaces Sigma Y Pi Qoi 2014 I Chocoteco Renteria Madai

Estructura Y Propiedades De Las Moleculas Organicas Ppt Video Online Descargar

Tomi Digital Enlace Covalente Sigma Y Pi
Orbitales Hibridos Sp3 Y Enlaces Sigma Video Khan Academy

Enlaces Pi Y Orbitales Hibridos Sp2 Video Khan Academy








Posting Komentar untuk "Como Se Forma Un Enlace Pi"